2019年7月25日 下午3:19
輝瑞藥廠的化療藥「多泰舒靜脈注射劑」近日驗出不明不純物,目前雖在合格範圍,但未來恐有超標疑慮,食藥署已扣下2000支問題藥品,要求8月22日前全面清查同款藥品並繳交調查報告。
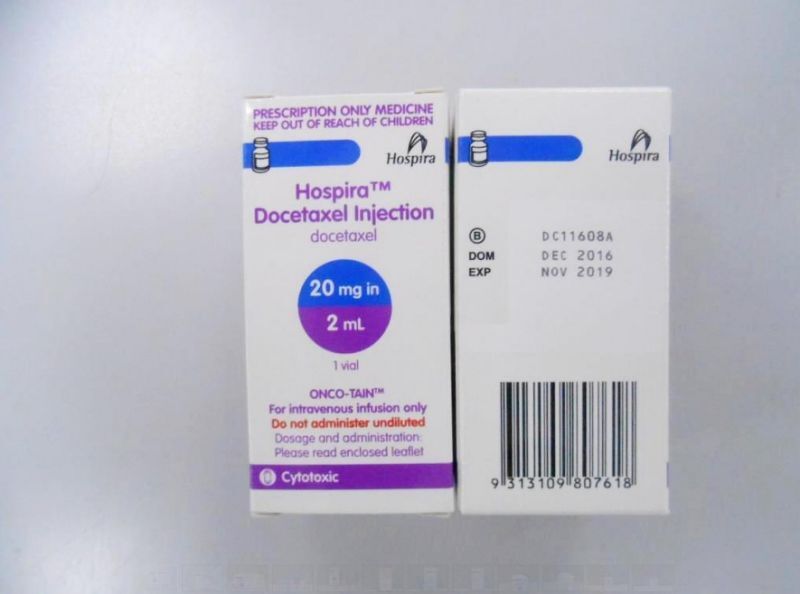
圖為在輝瑞藥廠網站中展示的多泰舒靜脈注射劑(擷取自輝瑞藥廠網站https://www.pfizer.com.tw)
更多
衛生福利部食品藥物管理署17日接獲香港發布的藥品回收訊息指出,美國輝瑞科研製藥有限公司主動回收藥品「多泰舒靜脈注射劑」(Hospira Docetaxel Injection,批號:DC11805C),由於藥廠在藥品中驗出不明的不純物,目前檢驗雖合格,但在效期將屆時可能有超標疑慮,因此啟動預防性下架回收。 食藥署藥品組科長洪國登表示,根據調查,該藥品在國內的藥證是由輝瑞大藥廠股份有限公司申請,該藥品是一種處方的化療藥物,須由醫師診斷並開立處方才可使用,主要成分為紫杉醇類抗癌藥(Docetaxel anhydrous),核准適應證為乳癌、非小細胞肺癌、前列腺癌、胃腺癌、頭頸癌等癌症。 洪國登說,進口台灣的問題藥品共有2批(DC11805C、DC11803H),數量約2000支,均未流入國內市場,已全數隔離儲存在業者的倉儲。 他指出,目前僅知業者在該藥品中驗出不明的不純物,但據業者說法,這次發現的不純物並非近年降血壓藥物驗出的致癌物質「N-亞硝基二甲胺」(NDMA)以及「N-亞硝基二乙胺」(NDEA),加上目前不純物濃度仍在合格範圍,因此暫時不會針對全批號產品進行預防性下架。 洪國登強調,由於目前藥廠仍無法交代不純物到底是什麼成分,也無從得知使用的後果如何,因此已要求藥廠展開調查,除了針對所有批號的同款藥品進行清查及檢驗,也得說明為何會有不純物生成及未來改善方法,最晚於8月22日前交出調查報告,未來若發現市售產品也出問題,不排除全面下架回收。
聯絡作者:動態骷髏 文章來源