本文選自中國工程院院刊《Engineering》2022年第6期
作者:張旭,王生,程國輝,於鵬,常津
來源:Light-Responsive Nanomaterials for Cancer Therapy [J]. Engineering,2022,13:18-30.
編者按
光療法因時空可尋址性、微創性和臨床相對安全性而受到了廣泛關注;光療法在生物醫學工程中不斷發展,以對抗皮膚病以及情緒和睡眠障礙。由光療劑的非特異性分布導致的靶向效率低是一個必須解決的重要問題。
天津大學常津教授研究團隊在中國工程院院刊《Engineering》2022年第6期發表《光響應納米材料在腫瘤治療領域的應用》。文章指出光療具有獨特的優勢,包括微創性和臨床相對安全性,所以被認為是一種有前途的癌症治療方法,但是光療的治療效果往往受到光穿透深度有限和光療劑靶向作用低的限制。光響應納米材料的出現為實現增強的光療效力提供了一種可能的方法。文章綜述了光響應納米材料在癌症治療中的生物醫學應用進展,包括光熱療法、光動力療法、光響應分子遞送和光控聯合療法;文章旨在論證光響應納米材料在癌症治療中的重要性,並為擴大光療的應用提供策略。
一、引言
近年來,光療法因時空可尋址性、微創性和臨床相對安全性而受到了廣泛關注。早在1903年,現代光療法的創始人Niels Ryberg Finsen就因使用陽光和紫外線(UV)輻射治療皮膚病(尋常狼瘡)而獲得諾貝爾獎。從那時起,光療法在生物醫學工程中不斷發展,以對抗皮膚病(如濕疹、銀屑病和皮膚瘙癢)以及情緒和睡眠障礙(如季節性情感障礙、非季節性抑鬱症和晝夜節律睡眠障礙)。在光治療劑如光敏劑和光熱轉換劑(PTCA)的幫助下,光療法也被證明是消融腫瘤的有效方法。
癌症光療中常用的光源包括紫外線(100~400 nm)、可見光(400~760 nm)和近紅外(NIR)線(760~1350 nm)。然而,由於對生物組織的吸收,廣泛使用的紫外線和可見光的組織穿透深度有限,使得傳統的光療法局限於淺表腫瘤,並可能導致腫瘤復發和轉移。此外,由光療劑的非特異性分布導致的靶向效率低是一個必須解決的重要問題。光療劑在治療過程中的非靶向遞送不僅會導致生物利用度低、療效差,還會引起副作用。
隨著納米技術的發展,各種基於多功能納米材料的光療納米製劑已被開發用於克服上述癌症光療中的局限性。由於增強的滲透和滯留(EPR)效應,具有特定尺寸範圍(20~200 nm)的納米製劑在腫瘤組織中富集。因此,納米材料具有作為載體將光敏劑、PTCA、藥物和基因等治療性分子遞送至腫瘤組織,從而實現靶向治療和聯合治療的潛力。為了解決光療中光穿透深度有限的問題,NIR光響應納米材料已被開發應用。例如,可以直接吸收NIR光並產生熱量的PTCA已被用於NIR觸發的光熱治療(PTT)。上轉換納米粒子(UCNP)可以吸收長波長的NIR光,並發射特定的短波長紫外線或可見光,以實現更深的穿透。因此,光響應納米材料提供了克服光療障礙和擴大光療應用的可能性。
文章總結了用於癌症治療的光響應納米材料的最新進展(表1)。這些納米材料可用於光熱治療、光動力療法(PDT)、光響應分子遞送和光控組合療法(圖1);還討論了光療法當前面臨的挑戰和前景。文章旨在強調光響應納米材料在癌症光療中的重要作用,並為進一步擴大其應用提供方向。
表1 光響應納米材料在癌症治療中的應用概述
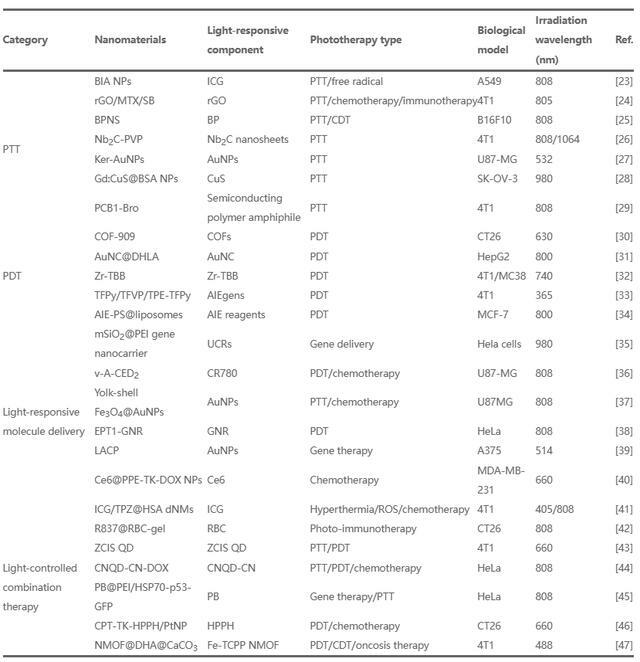
圖1. 光響應納米材料在癌症治療中的應用示意圖。
NP:納米粒子。
二、光響應納米材料
用於癌症光療的光響應納米材料包括PTCA、納米光敏劑和含有光響應部分的納米平台。PTCA是一種可以吸收光能並將其轉化為熱量以引發癌細胞死亡的物質。一般來說,PTCA可以分為有機材料和無機材料兩大類。常見的有機PTCA材料包括有機染料分子 [如吲哚菁綠(ICG)] 和有機納米顆粒(如半導體聚合物納米顆粒)。無機PTCA材料包括貴金屬材料 [如金(Au)納米材料]、過渡金屬硫化物和氧化物 [如硫化銅(CuS)NP] 以及碳基材料(如)。
光敏劑可以被特定波長的光激活,產生活性氧(ROS),並通過局部氧化應激損傷癌細胞。光敏劑還分為有機光敏劑和無機光敏劑。有機光敏劑包括有機染料分子,如卟啉和吡咯硼(BODIPY);而無機光敏劑包括二氧化鈦(TiO2)、氧化鋅(ZnO)、石墨氮化碳(g-C3N4)等。
許多光響應納米平台是通過利用光響應連接體設計和開發的,如偶氮苯。這些納米平台可作為高效的納米載體,用以實現光響應分子的遞送。除了通過設計這種納米平台來直接響應光之外,還可以通過級聯策略進行響應。例如,由光熱劑(PTA)和熱敏連接劑組成的納米材料可以對光照射做出響應。此外,光誘導的ROS的產生會導致一些化學鍵的斷裂,如縮硫酮(TK)鍵,從而實現光觸發的藥物釋放。
三、光熱療法
PTT是一種很有前途的治療方法,在癌症治療中具有微創和高治療效果。在外部光線的照射下,PTCA吸收光能並將其轉化為熱量,從而殺死癌細胞。PTCA通常需要具有高NIR吸收和高光熱轉換效率。在過去的幾十年裡,各種基於納米材料的PTCA,如金納米材料、黑磷(BP)、碳化鈮、石墨烯、金屬/非金屬化合物和有機染料,已被開發用於PTT。例如,El-Sayed等報導了金納米棒(GNR)輔助的等離子體PTT是傳統手術的潛在且有效的替代方案。此外,GNR輔助的PTT可以通過調節和重塑肌動蛋白絲和細胞連接蛋白來減少癌細胞的集體遷移。De Sio等報導了一種角蛋白塗層仿生金NP(Ker-AuNP),可用作等離子體PTT的高效PTCA。
Zhang等基於釓(Gd)整合的硫化銅(CuS)NP開發了一種無機納米診療劑 [Gd∶CuS @牛血清白蛋白(BSA)NP] [圖2(a)]。由於Gd∶CuS N的強NIR吸收和BSA修飾實現了良好的生物相容性,因此納米診療劑(Gd∶CuS@BSA NP)可作為一種優異的診療劑用於體內光聲(PA)/磁共振成像(MRI)指導的高效PTT。如圖2(b)所示,在NIR雷射照射下,Gd∶CuS@BSA納米顆粒的溫度明顯升高,表明Gd∶CuS具有良好的光熱效應。此外,Gd∶CuS@BSA NP在荷瘤小鼠體內24 h內顯示出PA/MRI成像信號的持續增強 [圖2(c)]。雙模態成像促進了成像引導的光療,導致有效的腫瘤消除。為了在體外驗證Gd∶CuS@BSA NP的PTT效應,對SK-OV-3細胞進行了細胞毒性研究和活/死細胞共染色。如圖2(d)、(e)所示,在雷射照射下,腫瘤細胞的相對存活率明顯降低,證明了Gd∶CuS@BSA的腫瘤消融效果。Gd∶CuS@BSA的光熱效應也在體內得到了證實。如實時熱圖像 [圖2(f)]所示,當用Gd∶CuS@BSA NP治療時,腫瘤部位的溫度升高了21 ℃,顯著高於對照組的溫度升高(6 ℃)。在NIR雷射照射下,腫瘤顯著消退,隨後被完全消除 [圖2(g)],這證明了PTT的顯著腫瘤消融效果。
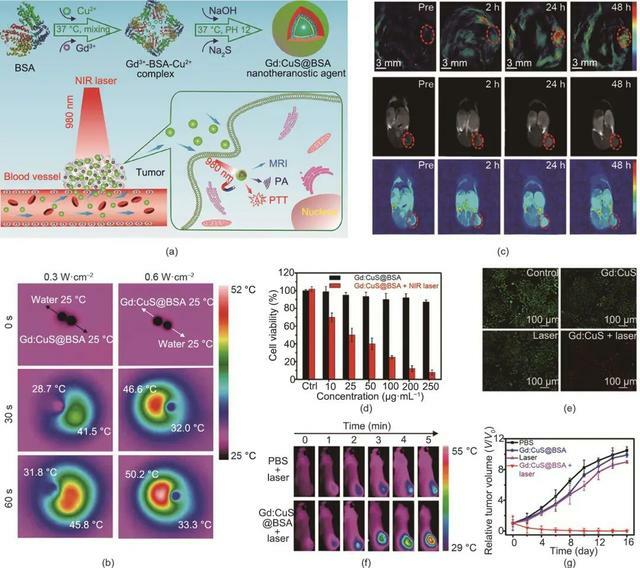
圖2. (a)用於成像引導腫瘤PTT的Gd∶CuS@BSA納米診療劑的示意圖。MRI:磁共振成像。(b)用NIR雷射照射(980 nm)的Gd∶CuS@BSA NP的水相Gd∶CuS @ BSA NP液滴和去離子水液滴的紅外熱圖像。(c)在Gd∶CuS@BSA治療前後SK-OV-3腫瘤的PA/MR雙模態成像。(d)用Gd∶CuS@BSA NP和雷射照射(980 nm, 0.6 W∙cm-2, 5 min)處理的SK-OV-3細胞的生存率。Ctrl:對照組(用0 μg mL-1Gd∶CuS @ BSA NP處理)。(e)用不同製劑處理後活/死SK-OV-3細胞的螢光染色。(f)注射不同製劑並進行雷射照射(980 nm, 5 min)的SK-OV-3腫瘤的體內熱成像。(g)用不同製劑治療的SK-OV-3腫瘤的生長曲線。經American Chemical Society許可,© 2016。
除了無機納米材料外,有機納米製劑在癌症PTT中也發揮著重要作用。例如,美國食品藥品監督管理局(FDA)批准的ICG是一種高度生物相容的NIR有機染料,由於其在NIR光激發下的各種能級轉換途徑,已被廣泛應用於PTT。此外,Pu等報導了具有用於增強癌症治療的NIR光熱效應的半導體聚合物納米酶(SPN)。如圖3(a)所示,SPN包含作為光熱納米傳感器的半導體兩親性聚合物(PCB)和作為溫度敏感酶的菠蘿蛋白酶(Bro)。在NIR雷射照射下,由於SPN的光熱轉換活性,局部溫度升高,導致Bro的光熱激活。因此,膠原蛋白(腫瘤細胞外基質中最豐富的蛋白質)被原位消解,導致SPN的腫瘤富集量提升和PTT增強。在808 nm雷射照射下,PCB1-Bro基團的溫度在體外 [圖3(b)]和體內 [圖3(c)]均明顯升高,這證實了PCB1-Bro的高光熱轉換效率。此外,與沒有雷射照射的滲透深度相比,用NIR雷射照射的PCB1-Bro的滲透深度明顯增加,表明光熱增強的膠原蛋白消解已經發生。如圖3(d)所示,在Bro酶光熱激活後,PCB1-Bro處理組的腫瘤螢光信號高於其他組,表明膠原蛋白的消解增強了PCB1-Bro的腫瘤富集。PCB1-Bro的有效積累進一步導致更高的腫瘤溫度和更強的腫瘤生長抑制 [圖3(c)、(e)]。
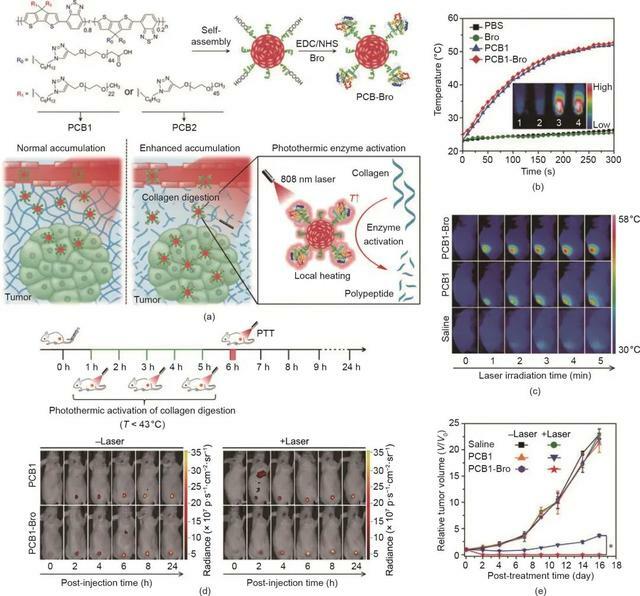
圖3. (a)PCB 1-Bro在光熱增強NP腫瘤中富集的示意圖。EDC/NHS:1-乙基-3-(3-二甲基氨基丙基)碳二亞胺/N-羥基琥珀醯亞胺。(b)雷射照射時不同樣品的溫度變化。(c)用不同製劑和雷射照射(808 nm, 5 min)處理的4T1荷瘤小鼠的紅外熱圖像。(d)用有/無雷射照射的不同製劑處理的4T1荷瘤小鼠的實時螢光圖像。(e)採用不同治療方式的4T1腫瘤的生長曲線。經Wiley-VCH Verlag GmbH & Co. KGaA許可,© 2018。
由於PTT的優勢,一些PTCA已經進入臨床試驗。2019年,一期試驗的結果證明了一種涉及金-二氧化矽納米殼的方法用於前列腺腫瘤的局部PTT消融的可行性。此外,為了進一步提高光穿透深度,NIR-II光響應PTCA越來越受關注。例如,Yang等開發了一種聚乙二醇接枝聚乙烯亞胺修飾的中空碳納米球用於NIR-II雷射激活的癌症PTT。
四、光動力治療
PDT是一種經臨床批准的療法,用於癌症(包括淺表皮膚病變、食管腫瘤和肺部腫瘤)治療已有40多年。PDT包含三個基本要素:氧氣、光敏劑和光。數百種光敏劑已在臨床或臨床前被應用於PDT,包括卟啉、二氫卟酚和酞菁衍生物。在傳統的PDT過程中,光敏劑將光能傳遞給周圍的分子,以產生用於癌症治療的細胞毒性ROS。有兩種主要類型的光動力反應——I型和II型。在I型反應的機理中,三重態光敏劑通過電子轉移直接與細胞底物反應,從而產生自由基。然後,生成的自由基與氧氣(O2)反應產生氧化產物,包括超氧陰離子(O2‒)、過氧化氫(H2O2)和羥基自由基(·OH)。或者,在II型反應的機制中,三重態光敏劑將能量直接轉移到氧(3O2)以產生高反應性的單線態氧(1O2)。大多數現有的PDT系統採用氧依賴的II型機制。
與其他常規治療方法相比,PDT具有創傷小、操作空間準確、副作用小、無耐藥性和恢復期短等優點。然而,PDT也有很大的局限性,包括腫瘤的乏氧狀態、光敏劑的靶向效率低、光穿透深度有限等。此外,光敏劑的非特異性分布導致正常組織的光毒性,這必須加以考慮。由於對生物相容性和分子基序前沿軌道的嚴格要求,有效分子光敏劑的選擇仍然有限。為了解決這些問題,已經開發了許多具有多種特性的新型光敏劑來增強PDT的功效。例如,通過連接ROS惰性分子基序,已經開發出具有優異ROS產生效率的多孔共價有機框架(COF)。為了增強PDT在深層組織中的效果,UCNP和光敏劑的組合是一種有效的方法。Xing等提出了一種通過將UCNP與石墨烯量子點(GQD)整合來實現高效PDT的策略。UCNP可以作為光傳感器將NIR光轉化為可見光用於光敏劑的激活,從而大大擴展了PDT的應用。
此外,一些研究表明,通過I型光反應產生的自由基可以放大PDT反應,特別是在乏氧條件下。基於此,Yoon等報導了一種納米結構酞菁組裝體(NanoPcA),這種組裝體通過增強的I型PDT具有良好的抗菌效果。Jiang的研究小組開發了一種I型納米劑,即二氫硫辛酸包覆的金納米糰簇(AuNC@DHLA),用於雙光子抗癌PDT。在這種納米製劑中,金納米糰簇由於優異的生物相容性和長的螢光三重態壽命而被用作有前途的光敏劑。在另一項研究中,Lin等道了一種基於5,10,15,20-四(對苯並甲酸)菌綠素(TBB)配體的納米級金屬有機框架(NMOF),用於通過I型和II型機制增強PDT [圖4(a)]。作為一種納米光敏劑,NMOF具有高光敏劑負載效率、多孔結構和固有生物降解性的獨特性質。菌綠素在NIR區(700~850 nm)具有出色的吸收效果,可用於乏氧條件下的I型PDT。然而,菌綠素的PDT功效受到其對氧和光的不穩定性的顯著限制。NMOF的結構有利於穩定菌綠素的配體,從而防止單分子光解和自猝滅。如圖4(b)中的共聚焦雷射掃描顯微鏡(CLSM)圖像所示,Zr-TBB組產生了4種類型的ROS(O2‒、H2O2、·OH和1O2),證實了光誘導的I型和II型PDT過程的存在。因此,Zr-TBB對皮下4T1和MC38腫瘤顯示出優異的體內抗腫瘤功效 [圖4(c)]。
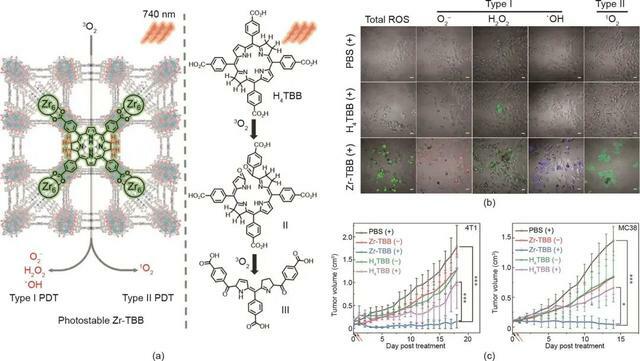
圖4. (a)用於I型和II型PDT的在Zr-TBB中穩定的菌綠素配體示意圖。(b)光照射後用不同配方處理的4T1細胞中ROS生成的CLSM圖像。比例尺:20 μm。(c)用不同製劑治療的4T1腫瘤和MC38腫瘤的生長曲線。經American Chemical Society許可,© 2020。
傳統的光敏劑,如卟啉衍生物是疏水性的,並且傾向於在水溶液中聚集。光敏劑的聚集狀態導致螢光猝滅,從而降低ROS的產生效率,並極大地限制PDT治療的結果。為了解決這個問題,Chen等開發了一種基於卟啉納米籠的單分子納米光敏劑。由於納米籠的剛性結構,光敏劑之間的π-π堆積相互作用被抑制,從而促進光敏效應。
聚集誘導發射(AIE)光敏劑的發展為克服傳統光敏劑的猝滅效應提供了另一種策略。最近,Tang等提出了一種基於三種聚集誘導發光體的「1 + 1 + 1 > 3」協同策略。AIEgens具有相同的光敏劑骨架,但具有不同的靶向基團,分別靶向線粒體、細胞膜和溶酶體 [圖5(a)]。如圖5(b)所示,在4T1細胞攝取後,這三種AIEgens表現出與相應細胞器的良好共定位。研究發現協同治療組的腫瘤抑制效果優於每種光敏劑單獨使用的效果,這歸因於協同PDT策略 [圖5(c)]。
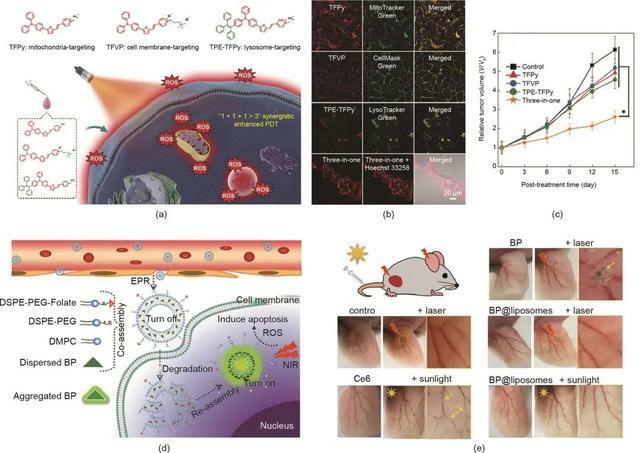
圖5. (a)三種聚集誘導光敏劑的化學結構和協同增強PDT的示意圖。(b)在用不同製劑處理的4T1細胞的CLSM圖像中AIEgens的共定位。比例尺:20 μm。(c)用不同製劑處理的4T1腫瘤的生長曲線。(d)用於可活化PDT的AIE-PS脂質體的示意圖。DSPE-PEG:二硬脂醯磷脂醯乙醇胺聚乙二醇2000;DMPC:1,2-二肉豆蔻醯-sn-甘油-3-磷酸膽鹼。(e)用不同製劑處理的耳朵中的血管。(a)~(c)經Wiley-VCH Verlag GmbH & Co. KGaA許可,© 2020;(d)、(e)經American Chemical Society許可,© 2019。
由於光敏劑的非特異性生物分布,大多數光敏劑在患者暴露在陽光下時會引發光毒性。為了降低光毒性,可活化的PDT是一種有前途的策略。例如,Li等開發了一種載有光敏劑的脂質體(AIE-PS@脂質體)以實現受控的光敏化。如圖5(d)所示,包裹在脂質雙層中的AIE-PS的光敏性處於「關閉」狀態;然而,一旦AIE-PS脂質體到達腫瘤部位,AIE-PS被釋放用於原位再聚集,導致活化的PDT。正如預期的那樣,與對照組 [包括AIE-PS納米聚集體和商業光敏劑二氫卟吩e6(Ce6)]相比,AIE-PS脂質體在雷射和日光照射下表現出較低的光毒性 [圖5(e)]。
五、光響應分子遞送
癌症治療中治療劑的低靶向性導致在正常組織中不令人滿意的療效和嚴重的副作用。隨著刺激響應型給藥系統的發展,越來越多的基於聚合物和無機納米材料的納米載體已被開發用於實現藥物、光敏劑、基因等的靶向給藥。作為一種外部刺激,光具有獨特的功能,用於控制治療劑在精確位置的釋放行為,並避免個體差異。例如,熱響應納米材料可以通過光熱誘導的連接鍵斷裂、納米載體的結構變化、自由基生成和其他途徑實現光觸發藥物輸送。光敏劑在光照射下產生的ROS也可以通過觸發ROS敏感化學鍵(如TK化學鍵)的裂解而實現按需給藥。
Liang等開發了二氮嗪(DA)修飾的人血清白蛋白(HSA)納米藥物(稱為HAS dNM),用於通過靜電和疏水相互作用共同封裝光敏劑(ICG)和前藥替拉扎明(TPZ)[圖6(a)]。如圖6(b)所示,在405 nm雷射照射下,DA基團轉化為反應性卡賓部分,並與相鄰的HSA dNM反應交聯,導致ICG/TPZ@HSA dNM在腫瘤部位增強的富集和滯留。接下來,808 nm雷射照射觸發了高溫和ROS的產生,用於腫瘤PTT和PDT。此外,PDT過程中的耗氧導致腫瘤乏氧加重和TPZ激活,從而實現協同治療。體外和體內結果都證實了HSA dNM的光響應遞送。在暴露於405 nm的雷射後,具有DA修飾的HSA dNM的尺寸明顯增加 [圖6(c)],驗證了紫外線觸發的聚集行為。ICG/TPZ@HSA dNM在體內的腫瘤富集量由腫瘤與組織的螢光信號比率計算的成像對比指數(CI)來表示。紫外雷射治療組的CI值明顯高於沒有雷射照射的對照組,證實了ICG/TPZ@HSA dNM的雷射增強腫瘤富集行為 [圖6(d)]。基於生物分布螢光圖像,獲得了一致的結果。如圖6(e)所示,雷射治療後腫瘤的螢光強度顯著增加。這種精心設計的ICG/TPZ@HSA dNM通過光誘導聚集和級聯光療/化療,增強了ICG/TPZ的靶向輸送,提高了抗癌療效。
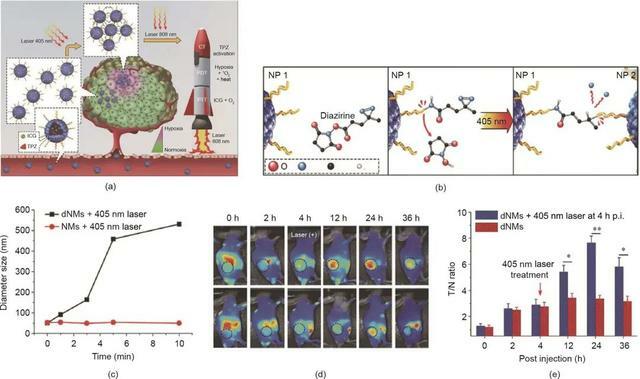
圖6. 用於癌症治療的光響應藥物/光敏劑遞送系統。
(a)通過雷射(405 nm和808 nm)照射觸發級聯協同癌症治療的ICG/TPZ@HSA dNM示意圖。CT:化療。(b)ICG/TPZ @ HSA dNM的405 nm雷射誘導聚集的方案。(c)HSA dNM的尺寸隨不同的連續雷射照射時間的變化。(d)ICG/TPZ @ HSA dNM的腫瘤富集,由CI值表示。(e)ICG/TPZ @ HSA dNM在4T1荷瘤小鼠體內的生物分布。T/N:腫瘤與組織的螢光信號比;p.i.:注射後。經Wiley-VCH Verlag GmbH & Co. KGaA許可,© 2018。
除了藥物和光敏劑的輸送,納米材料還可以用於基因治療中基因表達的光控選擇性激活。例如,光遺傳學是光學和遺傳學方法的結合,以精確控制特定細胞中蛋白質的表達,從而控制細胞內的生物過程和行為。與大多數依賴紫外線/可見光照射的光觸發遞送系統一樣,光遺傳學中光致動器的激活受到光穿透深度的嚴重限制。為了解決這個問題,UCNP可以作為一種納米轉換器,將具有較深穿透深度的外部NIR光轉化為局部紫外線/可見光,用於體內光感受器的無創激活。
Chang等開發了一種上轉換光遺傳納米系統,由UCNP、擬南芥黃素蛋白隱色素2(Cry2)及其相互作用夥伴Cib1質粒組成。UCNP在質粒DNA(pDNA)遞送和光轉化中都起作用。外部NIR光觸發的局部藍光發射非侵入性地誘導光感受器Cry2和Cib1相互作用,激活了癌細胞的凋亡信號通路。在另一項工作中,Chang的研究小組報導了一種基於介孔二氧化矽(mSiO2)@聚乙烯亞胺(PEI)納米載體共軛上轉換棒(UCR)的NIR控制基因遞送系統 [圖7(a)]。在NIR光照射下,外部NIR光被UCR轉化為紫外線,從而引發鄰硝基苄基的裂解 [圖7(b)]。隨後,載有基因的mSiO2@PEI納米載體被釋放用於基因遞送 [圖7(c)]。這項基因表達研究報告了基因在NIR光照射下被釋放和表達,證實了在高空間和時間解析度下光控精確調節的基因表達已經實現。
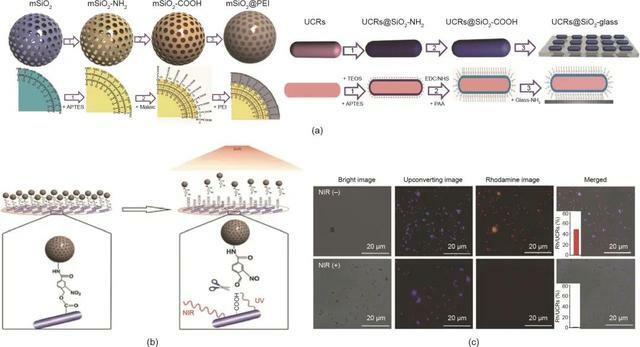
圖7. 光響應基因的遞送和表達。
(a)mSiO2@PEI基因納米載體和UCR底物的合成步驟。APTES:3-氨丙基三乙氧基矽烷;TEOS:原矽酸四乙酯;PPA:聚丙烯酸。(b)由於鄰硝基苄基的光裂解,mSiO2@PEI基因納米載體從UCR底物的光觸發釋放的示意圖。(c)在有或沒有NIR雷射(980 nm, 8.9 W·cm-2, 12 min)的情況下,用負載羅丹明的mSiO2@PEI納米載體固定的基質的螢光圖像。經Wiley-VCH Verlag GmbH & Co. KGaA許可,© 2015。
六、光控聯合療法
雖然近年來光療技術得到了發展,但單一模式光療(僅依賴於一種治療方法)的一些缺點仍有待解決,如治療持續性腫瘤的復發或轉移。為了解決這一問題,將光療與免疫療法、基因療法、化學療法、化學動力學療法(CDT)和其他治療方法相結合,可以最大程度地發揮每種治療模式的優勢,實現互補的多模式治療效果。
光免疫療法可以消除原發性腫瘤並誘導宿主免疫以控制遠處轉移,被認為是治療轉移性癌症的一種有前途的策略。例如,Wang等開發了一種用於癌症光免疫療法的基於可注射紅細胞(RBC)的凝膠。在皮下注射咪喹莫特(R837)佐劑工程化紅細胞後,由於滲透的血小板和凝血酶,自發形成水凝膠樣組合物。原位形成的RBC凝膠的光熱效應導致腫瘤的光消融和腫瘤相關抗原的產生,從而啟動對癌症的適應性免疫反應。此外,釋放的免疫佐劑R837可誘導強大且持久的免疫反應,以抑制癌症轉移/復發。
Liang的研究小組開發了一種基於CuInS/ZnS(ZCIS)量子點(QD)的「一體化」納米藥物,用於PTT/PDT協同治療。量子點因其高螢光強度和寬激發光譜而被廣泛用於腫瘤診斷和治療。ZCIS量子點在650~750 nm範圍內的高吸收效應使得無創螢光/多光譜光學層析成像成為可能。此外,ZCIS量子點的光熱和光動力效應可用於癌症治療 [圖8(a)]。
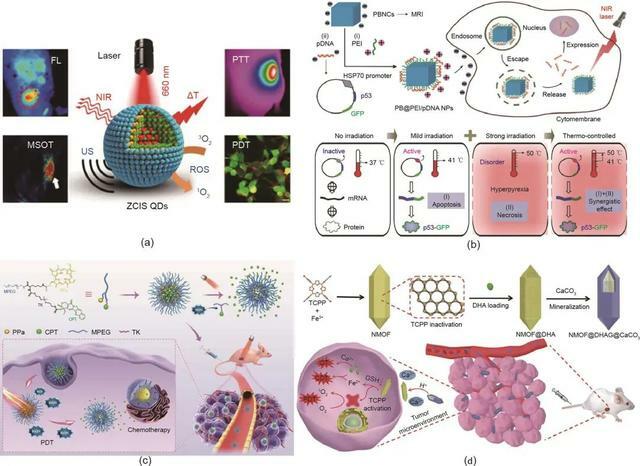
圖8. 光控組合癌症療法。
(a)在PTT和PDT的組合治療中ZCIS QD的示意圖。FL:螢光;MSOT:多光譜光聲層析成像:US:超聲波;∆T:溫度升高。(b)基因治療和PDT聯合治療中PB@PEI/HSP70‐p53‐GFP NP的示意圖。(c)MPEG-(TK-CPT)-PPa在化療和PDT聯合治療中的示意圖。(a)經American Chemical Society許可,© 2016;(b)經Wiley-VCH Verlag GmbH & Co. KGaA許可,© 2018;(c)經Wiley-VCH Verlag GmbH & Co. KGaA許可,© 2020;(d)經Wiley-VCH Verlag GmbH & Co. KGaA許可,© 2019。
Chang等報導了一種基於人類HSP70啟動子的普魯士藍(PB)納米立方體的多功能納米治療劑(PB@PEI/HSP70-p53-GFP NP),用於NIR光觸發的PTT/基因聯合治療。如圖8(b)所示,由於PB納米立方體的光熱特性,HSP70啟動子在溫和的NIR雷射(約41 ℃)照射下被激活,導致腫瘤抑制因子p53依賴性細胞凋亡。在強NIR雷射照射下(約50 ℃),PTT和基因治療都被激活。因此,協同抗腫瘤功效可以通過NIR雷射照射來調節。
化療與光療相結合是實現協同治療的另一個重要途徑。Qian等開發了一種ROS反應性前藥遞送納米平台,用於化療和PDT的組合。如圖8(c)所示,化療藥物喜樹鹼(CPT)和光敏劑焦脫鎂葉綠素-a(PPa)與甲氧基聚乙二醇(MPEG)連接製備聚合物前藥,進一步自組裝成納米藥物。螢光PPa精確定位腫瘤部位並引導雷射照射。接下來,由PPa介導的PDT過程產生的ROS破壞了聚合物和CPT之間的ROS響應TK鍵,導致CPT藥物的受控釋放。這種化學療法和PDT的組合表現出比單一療法更有效的抗腫瘤作用。
與PDT類似,CDT涉及產生用於腫瘤治療的高氧化性羥基自由基。Tang等基於負載DHA的鐵(Fe)-[4,4,4,4-(卟吩-5,10,15,20-四醯基)四(苯甲酸)](TCPP)NMOF和CaCO3礦化塗層構建了程序釋放系統 [NMOF @雙氫青蒿素(DHA)@碳酸鈣(CaCO3)] [圖8(d)]。腫瘤微環境的弱酸性導致CaCO3層溶解及Ca2+釋放。一旦NMOF@DHA進入癌細胞,細胞內的高穀胱甘肽(GSH)水平導致Fe3+還原和TCPP活化;這是由NMOF骨架崩潰導致的。因此,NMOF@DHA@CaCO3能夠實現Ca2+-DHA介導的腫瘤治療、Fe2+-DHA介導的CDT和TCPP介導的PDT。
七、結論和未來展望
光誘導光療由於微創性和輕微副作用而被廣泛用於對抗癌症。然而,光療的功效受到光穿透深度和光療劑非靶向分布的限制。光響應納米材料的出現為解決這些問題提供了一種有前途的方法,因為這種納米材料具有特殊的性質,包括納米尺寸、多功能表面修飾和可控合成。因此,通過光響應納米材料的合理設計,增強了光療效果。
文章綜述了近年來用於癌症治療的光響應納米材料的研究進展,包括PTT、PDT、光響應分子遞送和光控聯合治療。要實現精準的癌症光療,加速臨床轉化,應考慮以下幾個方面。
(1)光穿透深度的限制。光的穿透深度依賴於光的波長。紫外線和可見光由於有限的穿透深度而主要用於治療淺表性皮膚病。此外,當光與組織相互作用時,光在很大程度上出現衰減,阻礙了光療的應用,特別是在治療深層組織腫瘤中。雖然碳納米管的應用提供了一種增加光穿透深度的方法,但碳納米管仍然具有轉換效率低的缺點。與NIR-I窗口(750~1000 nm)相比,NIR-II窗口(1000~1350 nm)表現出較低的光散射、最小化的組織吸收和更高的最大允許雷射暴露;因此,NIR-II窗口似乎是實現深層組織穿透深度的潛在候選。因此,NIR響應納米材料在擴大光療應用方面顯示出巨大的潛力。
(2)潛在毒性風險。在光療的光觸發分子遞送過程中,藥物從納米載體中不受控制地爆發式釋放會導致短期毒性,而納米材料緩慢和不完全代謝可能會導致長期毒性。此外,光響應納米治療劑的非靶向生物分布可能導致陽光照射誘導的全身毒性。為了實現精確可控的癌症光療,理想的納米藥物應該只在腫瘤部位被激活,在正常組織中應該保持「關閉」狀態。因此,開發能夠響應腫瘤微環境的典型特徵的可活化的光治療劑是解決光毒性問題的有效方法。
(3)臨床轉化。為了實現多功能癌症治療,納米材料通常在設計和組成上都很複雜,這無疑給臨床轉化帶來了困難。此外,由於一些新開發的納米材料的未知毒性機制,這些納米材料的臨床應用需要複雜的毒性評估程序。
註:本文內容呈現略有調整,若需可查看原文。
改編原文:
Xu Zhang, Sheng Wang, Guohui Cheng, Peng Yu, Jin Chang. Light-Responsive Nanomaterials for Cancer Therapy [J]. Engineering,2022,13:18‒30.

註:論文反映的是研究成果進展,不代表《中國工程科學》雜誌社的觀點。