*僅供醫學專業人士閱讀參考
點擊右上方「關注」,準時接收每日精彩內容推送。
血管內近距離放射診治需要放射栓塞技術的進步,將優越的放射穩定性療效與簡單的綠色合成途徑相結合。
為此,廈門大學劉剛教授、毛景松副主任醫師、上海大學馬紅娟研究員聯合報導了一種利用磷酸化膽鹼修飾的鑥(Lu)-177配位聚合微球(177Lu-PCMs)的混合集成放射性微球策略,該策略通過輻射誘導移植物聚合用於成像引導的局部血管內近距離放射治療。利用第一性原理計算和密度泛函理論計算,闡明了177Lu-PCMs的形成機理,利用近邊和擴展X射線吸收細結構光譜研究了177Lu的形成機理。177Lu-PCMs具有優異的力學性能和良好的親水性和可控球直徑。這些特徵提供了超穩定的栓塞性放射治療藥物的優勢,這在不同的臨床前齧齒動物模型和分離的人肝腫瘤組織中得到了證實。在局部區域動脈內近距離放射治療期間,177Lu-PCMs可以通過檢查可視化,實時驗證體內生物分布和保留、實現精確的遞送、有效的抗癌治療以及顯著的安全性,不存在降解、異位栓塞和不良反應。因此,本研究為開發一種高度創新和轉化的精確動脈內近距離放射治療方法提供了一條新的途徑。
相關研究內容以「Engineering Radioactive Microspheres for Intra-Arterial Brachytherapy Using Radiation-Induced Graft Polymerization」為題於2023年8月7日發表在《Advanced Functional Materials》。
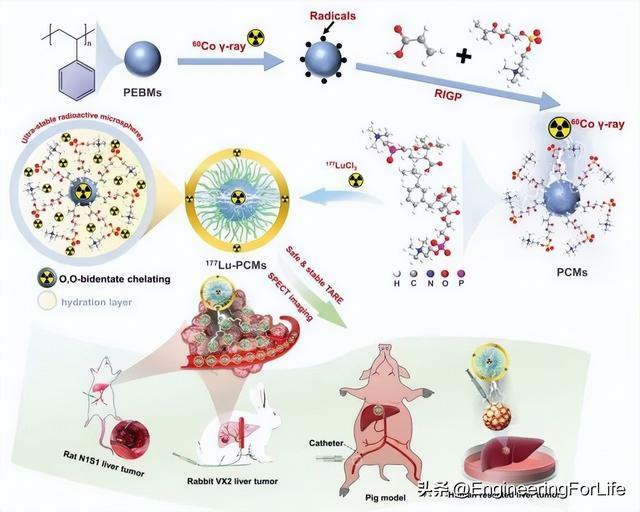
177Lu與O,O-雙齒螯合結構協調,實現安全穩定的動脈內近距離放射治療(IAB),並將成像引導診斷作為一種跟蹤177Lu-PCMs的無創方法(示意圖)。磷酸化膽鹼修飾的配位聚合物微球(PCMs)是通過一種新的包括乙烯苯(EB)的乳液懸浮液聚合(ESP)和2-甲基丙烯醯氧基乙基磷酸化膽鹼(MPC)和丙烯酸(AA)的60Co RIGP兩步聚合技術製備的(示意圖)。
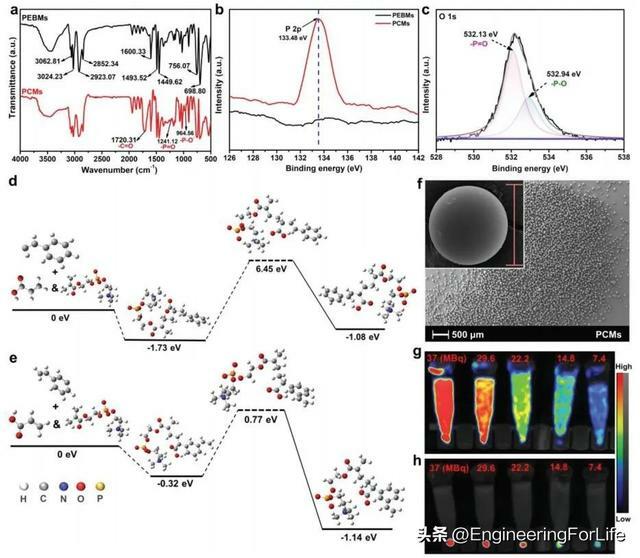
對於原始聚(乙烯基苯)微球(PEBMs),在3024.23和3062.81cm−1和2923.07和2852.34cm−1處的特徵峰分別為芳香族和脂肪族C-H拉伸振動,P = O、P-O和C = O的新拉伸振動分別發生在1241.12、164.56和1720.31cm−1,表明MPC成功嫁接到主幹PEBMs上(圖1a)。與PEBMs的XPS光譜相比,PCMs的XPS光譜顯示磷酸化膽鹼化外表面有獨特的P 2p峰(圖1b)。PCMs的O 1s譜在532.13和532.94 eV處可分為兩個峰,分別對應於磷酸化膽鹼組中P = O種和P-O種的氧含量(圖1c)。對RIGP的反應途徑進行了第一性原理的DFT計算,在RIGP過程中,反應物與TS之間的能壘分別為8.18和1.09 eV,這意味著它們分別具有吸熱性和放熱性(圖1d、e)。經過RIGP處理後,PCMs的表面沒有顯示出任何明顯的變化(圖1f)。177Lu-PCMs中的177Lu可以穩定地結合在PCMs上,當微球在表面掃描下沉降時,可以在試管底部觀察到(圖1g、h)。
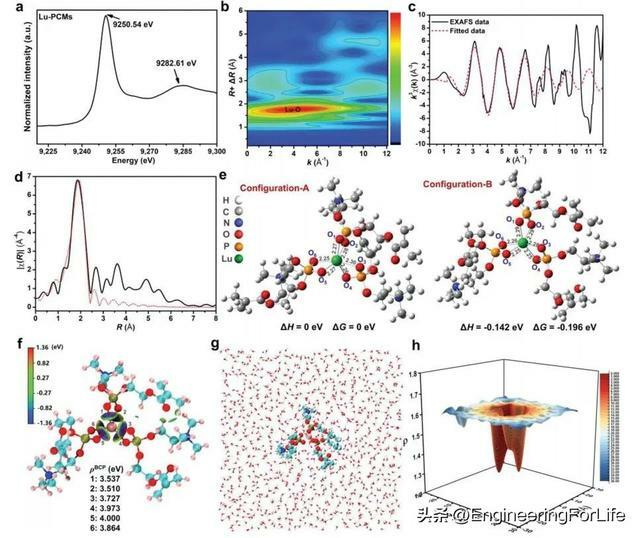
Lu-PCMs的X射線吸收近邊結構(XANES)光譜顯示,Lu-PCMs的Lu吸收邊緣為9250.54 eV,最大能量為9282.61 eV(圖2a),表明Lu在PCMs上吸附。Lu-PCMs的擴展X射線吸收精細結構(EXAFS)小波變換圖僅顯示出一個以k=4.0A−1和R = 1.8 A為中心的高強度,對應於Lu−O配位(圖2b)。EXAFS分析表明,在Lu-PCMs中,Lu周圍有兩種類型的Lu-O協調殼,距離分別為2.2和2.36A(圖2c、d)。結合能研究表明,螯合構型B是最穩定的(圖2e)。基於Hirshfeld的獨立梯度模型(IGMH)圖中的所有分子間相互作用顯示,Lu─O鍵(螯合構型B)的δginter值在−0.82−1.36eV之間(圖2f),這表明磷酸化膽鹼與Lu有很強的化學鍵合。用VMD模擬了填充水分子的螯合構型B的初始構型(圖2g)水分子空間密度分布函數顯示,Lu附近的水分子密度明顯小於其他區域(圖2h),表明螯合構型B周圍的水化層形成了能壘相互作用,協同提高了該構型的穩定性。
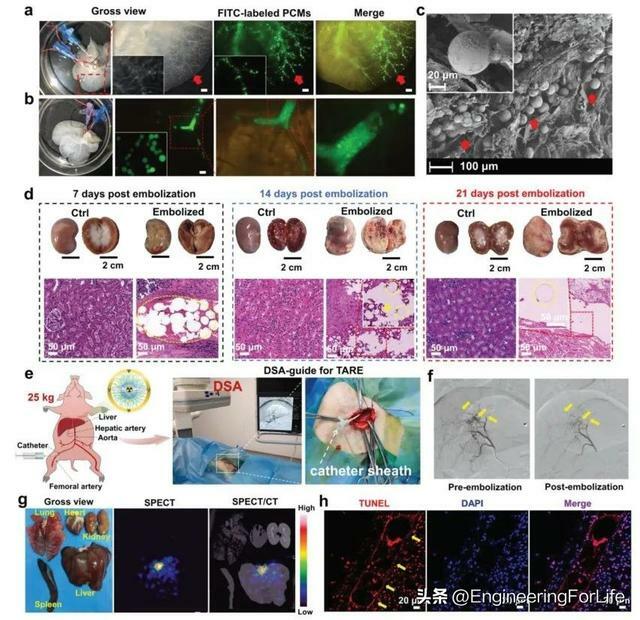
微球可以有效地沉積和栓塞相應的血管床,特別是肝臟的遠端周圍血管(圖3a)。注射FITC標記的PCMs後,完整的大鼠去細胞肝臟立體鏡圖像顯示,顆粒大小為117.2 μm的PCMs只能分散並栓塞於肝內血管幹(圖3b)。注射FITC標記的PCMs後,去細胞大鼠肝臟的掃描電鏡圖像顯示,注射、冷凍和乾燥後血管內的微球仍保持規則的球形形態(圖3c),表明它們具有較強的穩定性和抗壓縮性。術後在體外觀察標本,同時對靶腎進行H&E染色,在栓塞術後第7天,與對側正常腎相比,栓塞腎的腎實質出現充血和水腫;栓塞後第14天,腎實質變黑,HE染色顯示許多腎組織細胞壞死;栓塞後21天,腎實質萎縮,HE染色顯示有大量嚴重的組織壞死(圖3d)。採用原位肝栓塞的豬模型評估177Lu-PCMs的放射穩定性和生物相容性(圖3e)。在177Lu-PCMs栓塞後,靶肝段血管床迅速完全阻斷(圖3f),提示177Lu-PCMs在大型動物中仍保持良好的栓塞。即使在沒有腫瘤微血管床的情況下,PCMs中也沒有發生肺分流,這阻止了放射性肺炎的發展(圖3g)。TUNEL免疫組化染色顯示177Lu-PCMs處理的肝段組織中凋亡率較高(圖3h),可以觀察到177Lu-PCMs的印跡在肝動脈血管中排列整齊、有規律。
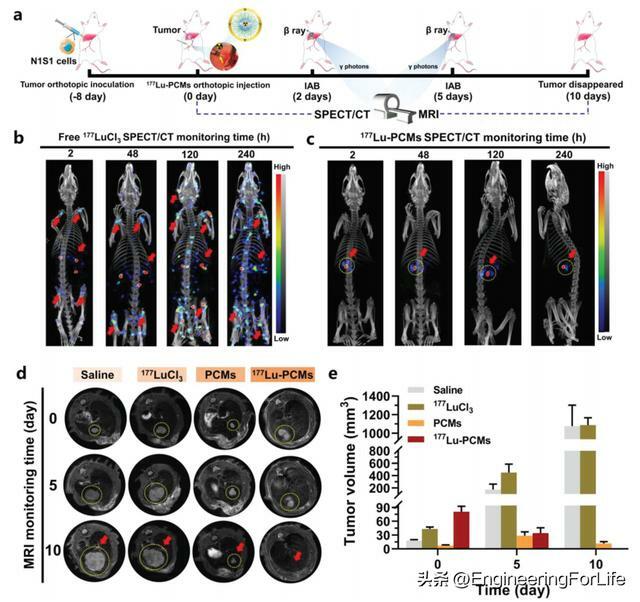
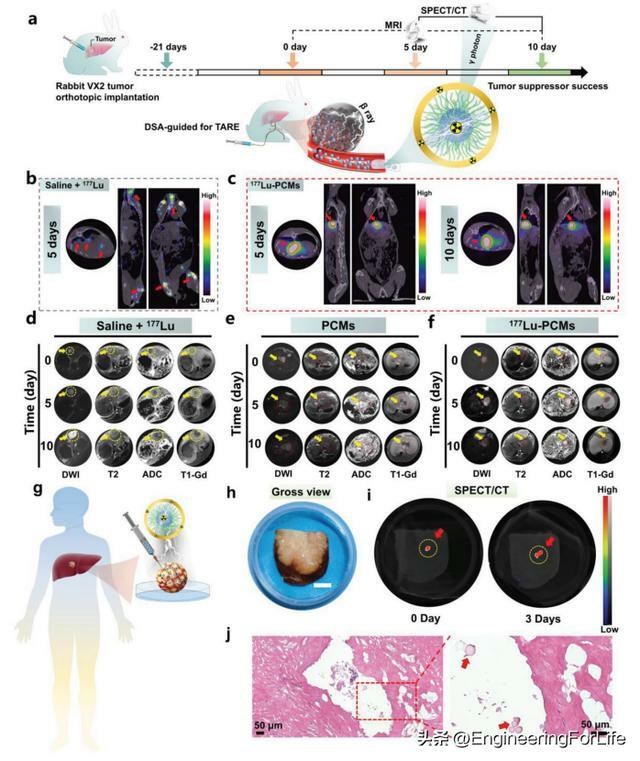
由於177Lu-PCMs具有良好的體內外生物相容性,因此構建了原位肝癌大鼠模型來驗證177Lu-PCMs的抗腫瘤療效和外觀成像性能(圖4a)。游離177LuCl3對照組的代表性SPECT/CT 圖像顯示,隨著時間的推移,177Lu從大鼠腫瘤部位顯著擴散到全身,特別是在骨關節炎腔內(圖4b)。相反,177Lu-PCMs組的代表性SPECT/CT圖像顯示,隨著時間的推移,大鼠的其他器官或組織中沒有177Lu-PCMs的攝取(圖4c),這表明177Lu-PCMs在體內非常穩定。177Lu-PCMs對腫瘤的IAB有顯著的治療效果,經IAB治療10天後腫瘤完全消退(圖4d、e)。使用177Lu-PCMs作為兔VX2肝腫瘤體內介入IAB的治療藥物(圖5a)。游離177LuCl3組的SPECT/CT圖像顯示全身呈瀰漫性γ光子信號,提示177Lu遍布全身,在脊柱和關節腔內高度富集(圖5b)。177Lu-PCMs沉積在腫瘤區域,有明顯的高γ光子信號,而正常肝組織和身體其他部位沒有明顯的信號(圖5c)。注射游離177LuCl3後,T2WI圖像顯示腫瘤繼續生長,彌散加權成像(DWI)和表觀擴散係數(ADC)圖像也顯示腫瘤活性的增強未被抑制(圖5d)。與177Lu-PCMs組相比,空白PCM組腫瘤邊緣有更多的腫瘤組織(圖5e)。通過T2WI計算得到的腫瘤體積曲線顯示,177Lu-PCMs組的腫瘤抑制能力比PCM組更顯著,且幾乎沒有腫瘤生長(圖5f)。本研究收集10個新鮮切除的人肝腫瘤,並將177Lu-PCMs直接注射到腫瘤組織中(圖5g)。對腫瘤組織進行拍照(圖5h),注射後0天和3天獲得SPECT/CT圖像,顯示人切除肝腫瘤注射部位存在177Lu(圖5i)。注射區域的組織學評價顯示,具有良好的抗腫瘤作用,腫瘤細胞核染色很少,與未處理的腫瘤組織比較明顯(圖5j)。
綜上,本研究結果為DSA引導下的177Lu-PCMs局部血管內注射是一種安全可行的肝癌治療方法提供了證據。通過將乳液懸浮液聚合和輻射誘導接枝聚合相結合,本研究展示了一種強大的通用放射性微球策略,可以實現大規模製造、超穩定的放射性標記和有效的腫瘤控制,同時滿足抗腫瘤治療的療效標準。177Lu-PCMs近距離放射治療、栓塞的放射治療特性保持不變,無任何降解、異位栓塞和不良反應,因此符合臨床應用的安全標準。177Lu-PCMs在機械上比商業上可獲得的放射性微球更堅固,並且在體內具有更好的治療特性。除了良好的近距離腫瘤治療效果外,177Lu-PCMs作為抗血管生成抑制劑和免疫檢查點抑制劑載體,作為個性化和多功能工程放射性微球,用於提供抗血管生成藥物、免疫檢查點抑制劑或其他具有病變區域藥物長期穩定的治療藥物。
了解更多
關注「EngineeringForLife」,了解更多前沿科研資訊~